第24章 麻酔のリスク
- p705: 麻酔に伴う死亡率は1987年の周術期死亡に関する秘密調査Confidential Enquiry into Perioperative Deaths (CEPOD)では1/185,000症例であるが,約30年前のBeecherとToddの報告では1/2,680症例
麻酔に関連した死亡
- p707: 死亡率はASAの身体状態Physial Status Classificationスコアとよく相関
- p708: 術後の呼吸抑制が,麻酔のみに起因する死亡や昏睡の最大の原因
- p709: 410例の周術期死亡のうち,9例は誤嚥または嘔吐,18例は心停止,高齢女性の大部分は大腿骨頸部骨折
- p710-711: 小児では成人の3倍の心停止の危険性,1例を除く全症例で心停止に先行して徐脈が進行
- p711: 麻酔に起因する心停止の原因としては,換気不十分(27人),スキサメトニウム後の心静止(23人),導入後の低血圧(14人)
- p712: アテノロールが周術期のプラークの安定性を高め,結果的に長期生存率を改善
- p712: バイスペクトルインデックスbispectral index (BIS)モニターで評価した麻酔深度が深いほど,術後1年での死亡率が高い
患者に関連したリスク
- p712: 死亡率を悪化させる有意な危険因子に,麻薬を用いた麻酔法,1-2種類の麻酔薬のみが投与された場合
- p714: 客観的なGoldman Cardiac Indexが主観的なASA身体状態分類よりも高い価値を追っているとはいえなかった.
特殊な患者群
- p716: [産科]全身麻酔の場合,死亡の73%は気道の問題
- p717: [小児]年齢の低い乳児ほどリスクが高い.多くの死亡が麻酔リスクの低い症例
- p718: [高齢者]リスクは年齢と相関するのではなく合併している疾病に相関
麻酔薬に直接関連するリスク
手術に関連するリスク
- p719: 鼠径部以下の血管手術も同様の心合併症発生率を有している
麻酔実施者に関連するリスク
- p720: 術者の技術や経験が危険性に影響する可能性
- p720: 90の麻酔に関連した死亡のうち約半数は手術室で発生しており,19は導入中に発生
- p720-721: 最も死亡率が高かったの(1/11,432手技)のは歯科医から麻酔を受けた患者
- p721: 死亡(1.13, 95%信頼区間: 1.00-1.26, p<0.04)ならびに蘇生失敗(1.13, 95%信頼区間: 1.01-1.27, p<0.04)の相対危険率は,資格を有しない中程度の経験を有する麻酔科医が麻酔を行った場合に高かった.
麻酔科医のリスク
偽性アルドステロン症の機序は?
我らがバイブル、year note 2016 D-74より
腎型11β-HSD2の阻害によりコルチゾールからコルチゾンへの不活化が阻害される.このためミネラルコルチコイド受容体に結合するコルチゾールが増加,原発性アルドステロン症と同様の徴候を示す.
と、しっかり記載されている。
11β-HSD(P45011β)には1と2があって、11β-HSD1はコルチゾールを合成(以前のエントリに代謝マップあり)、11β-HSD2は不活性化する。甘草が阻害するのは11β-HSD2の方で、コルチゾールが不活性化されないからいっぱい溜まり、アルドステロン作用を示す。
のだが、この機序がなかなか脳に定着しないので、深めるためにこの資料。
甘草は,主要成分としてトリテルペンサポニンであるグリチルリチン酸(GL)を含んでいる. GLには抗炎症作用があり,肝機能改善薬として内服剤だけでなく注射剤としても使用されている.GLは,そのアグリコン部であるグリチルレチン酸(GA)1分子に対して,3位の水酸基に2分子のグルクロン酸 が結合した構造を持つ配糖体である.漢方薬を構成する生薬として甘草を経口投与した場合, GLはその糖部の水溶性の高さのために消化管上皮を透過しにくく,大腸に生息する腸内細菌によって糖部が加水分解されたGAとして吸収されることから, 薬理活性本体はGAであるとされている.
グリチルリチン酸(GL)が直接働くわけでなく、腸内細菌代謝を受けたグリチルレチン酸(GA)が作用するのね、新発見。
さらに、なぜ甘草摂取による偽性アルドステロン症の発症に個人差があるのかというと、
1995年に加藤らは,甘草含有漢方処方や強力ミノファーゲンシーなどのGL製剤を使用した患者において,偽アルドステロン症を発症した患者と発症しなかった患者の血漿に含まれる甘草由来の代謝物の濃度を比較した.その結果,偽アルドステロン症を発症しなかった患者では検出することのできなかった3-モノグルクロニルグリチルレチン酸(3MGA)を,発症した患者の血漿においてのみ検出したことを報告した.このことから,血液中に3MGAを代謝物として出現させるという個人の体質が,偽アルドステロン症の発症と関連していることが推測されている.
とあり、GAがさらに肝代謝を受けた3MGAが11β-HSD2の主要阻害物質と考えられてるとのこと、これまた新発見。
おまけで
甘草に副腎皮質ホルモン様作用があることは古くから知られており,かつてはGLやGAが鉱質コルチコイド受容体に結合することによって偽アルドステロン症を起こすと考えられていた.
らしく、だからついついそんな気がしちゃうのかーとちょっと胸を撫で下ろしつつ、情報up to dateの重要さを改めて噛みしめるのであった。
ACTH値が不明でもCushing症候群を鑑別できるか?
Cushing症候群を見たら、まずは下垂体性か非下垂体性かを鑑別するためにACTH値に飛びつきたくなるようなもんだが、さてここで次の問題。
28歳の女性.1年前から徐々に進行する中心性肥満,顔面の多毛症,高血圧を認めている.身長154cm,体重64kg,BMI27.0,顔面は円形,赤ら顔で,下腹部に赤色皮膚線条,鎖骨上と背部に脂肪沈着を認め,近位筋の筋力低下が著明である.血液検査:Na 142mEq/l,K 3.2mEq/l,血清コルチゾール(午前8時)21µg/dl,(午後12時)19µg/dl(基準値 7~18),血漿レニン活性1.0ng/ml/h(基準値0.8~2.4),血漿アルドステロン濃度180pg/ml(基準値50~200).本症例のクッシング症候群で最も可能性が高い原因を一つ選べ.
(1) 副腎皮質癌
(2) 副腎皮質腺腫
(3) 下垂体性クッシング病
(4) 医原性クッシング症候群
(5) ACTH非依存性大結節性副腎過形成
お気付きの通り、ACTH値は与えられていない。これでどやって鑑別すんねん、という焦りを抑えてゆっくり考えてみる。
まず身体所見やコルチゾール微高値、日内変動消失などから、Cushing症候群は間違いなく存在しよう(問題文に書いてあるけど)。
次に、アルドステロンは基準値内だがやや高値。一方でレニンは基準最低値に近い。ということは、レニン抑制がかかっているにも関わらず、アルドステロン産生が亢進していると疑われる。そもそもコルチゾール高値であるから、アルドステロンは抑制傾向にあるはず。
つまり、この症例ではコルチゾールとアルドステロン両方が増加している。
では、選択肢(1)(2)(5)の副腎皮質性についてこの報告をもとに吟味してみよう。
(1)副腎皮質癌
癌専門病院と内分泌専門の病院・部署で頻度に差があるものの,機能性の癌が多く,内訳は成人の場合WHO分類によるとCushing症候群(45%),Cushing症候群と男性化(45%),男性化のみ(10%)で,アルドステロン産生癌はエストロゲン産生癌とともに稀で1%未満である.
もし副腎皮質癌であれば、コルチゾールのみ増加、あるいはコルチゾールとDHEA増加、あるいはDHEAのみ増加の3型が主となる。残念ながらDHEA値が与えられていないが、アルドステロン増加が稀という点で否定的だろう。
(2)副腎皮質腺腫
DHEAを産生する腺腫は稀なので、アルドステロンとコルチゾールを産生する腺腫についてみると、
アルドステロン産生腺腫(APA)
(中略)
通常APAは小さいので,コルチゾールの有意な産生はなく,皮質深層部の緻密細胞層の萎縮・消失はない.しかしAPAはしばしばP450aldoとP45011βの両者を有するhybrid cellからなるので,まれに4cmを越える腫瘍では,有意のコルチゾールも産生してpreclinical Cushing症候群を呈し,副腎皮質の緻密細胞層は萎縮・消失する.
稀にコルチゾールを産生することもあるけど、基本アルドステロンのみ増加。あってもアルドステロンが優位となるため否定的。
コルチゾール産生腺腫
(中略)
大部分のコルチゾール産生腺腫は緻密細胞に3βHSD活性を有し,DHEAなどの副腎性アンドロゲンを産生することは少なく,また上記の通り非腫瘍部副腎皮質は萎縮性のため網状層からのDHEA産生もなく,副腎性アンドロゲンの上昇はないことが多いのに対し,下垂体性Cushing症候群では,副腎皮質は下垂体腺腫からの過剰の ACTH刺激により,血中・尿中の副腎性アンドロゲン・17KSは増量する.また副腎皮質癌でもしばしば副腎性アンドロゲンは上昇し,両者と腺腫とのよい臨床的鑑別点 となる.後述するAIMAHと類似の組織像を呈する腺腫は肥大しているので,臨床的に癌との鑑別を要することが多い.
おっとここで(5)ACTH非依存性大結節性副腎過形成(AIMAH)についても述べられております。
コルチゾール産生腺腫とAIMAHは共に副腎皮質原発性Cushing症候群に分類されているので、コルチゾールのみ増加という理解でよろしいかと。
(4)医原性はコルチゾール紛いのものが作用するので内因性コルチゾールはそもそも抑制されるはずで、この病態に合致しない。
以上、長々とみてきましたが、コルチゾールとアルドステロンがどちらも微増、しかもコルチゾール優位で増加するのは、上流の下垂体から分泌されるACTHの異常でしか説明できない。ACTHによるアルドステロン合成調節作用はコルチゾールに対してよりもよっぽど弱い事実も生きてくる。
従って、答えは(3)の下垂体性クッシング病。
最初からACTH値出してたらものすごく単純な問題になるんだけど、ここまで深く考えさせる辺り、流石の一言に尽きます、Prof. Gentleman。
17α-水酸化酵素欠損症でアルドステロンは上昇するか?
難病情報センターの代謝マップを拝借いたしますと、
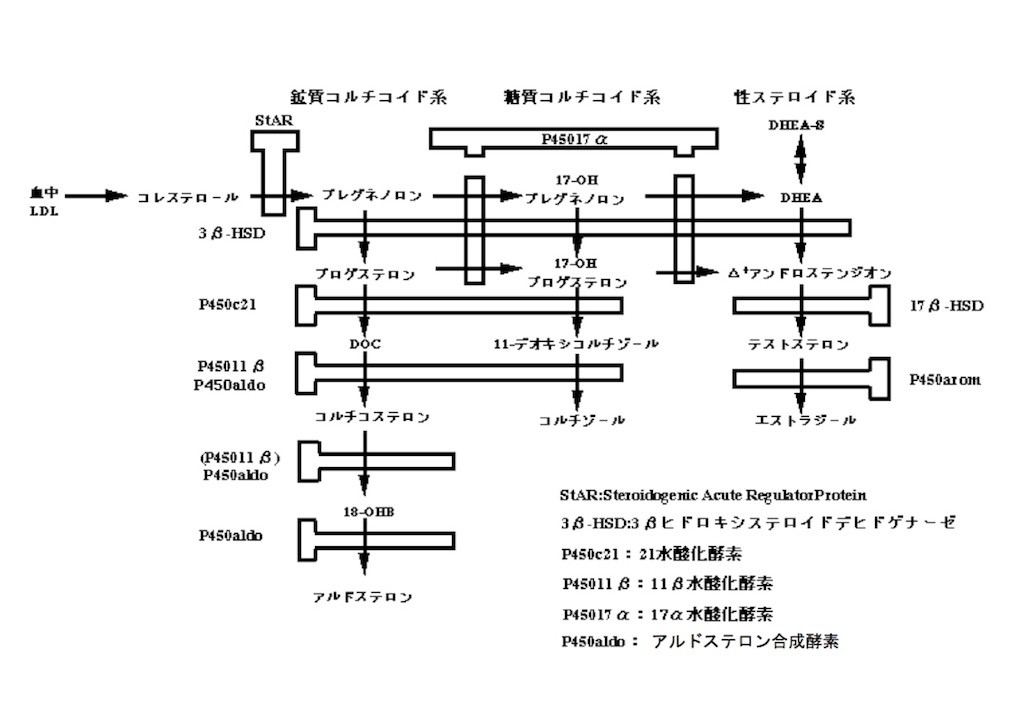
17α-水酸化酵素(P450-17α)を欠損していると、ステロイドホルモン合成の流れが図の右方へ行かなくなるので、図の下方へ流れてアルドステロン合成過剰となり、低カリウム性高血圧になる。
と単純に思っていたのだが、これ間違い。その中間代謝物であるDOCやコルチコステロンにも弱いながらアルドステロン作用があるために、アルドステロンへ行き着く前に低カリウム高血圧状態になり、むしろアルドステロンは合成に抑制がかかって低値になるのだそうな。
てことは、代謝マップから察するにアルドステロン合成の律速酵素はP450-aldoなんですよね、と調べてみたところ、昔懐かしEndocrinologyのMini Reviewに最近の知見がまとめてあった。

今はP450-aldoよりCYP11B2と呼ぶみたい。
律速機序としては、副腎皮質の球状層細胞膜のカリウムチャネルが常に外からカリウムを取り入れて、細胞膜を静止電位に保ってるけど、細胞外カリウムが高濃度になったり、あるいは低血圧からのレニン-アンジオテンシン系調節が入ると、細胞が脱分極してCYP11B2の発現が誘導されてアルドステロン合成が増えるということらしい(遺伝子レベルの発現誘導には数時間以上かかり、アルドステロン合成調節は数十分単位だと思うが、ここでそのdiscrepancyについて深追いはやめとく)。
従って逆説的に、低カリウム高血圧状態がDOCやコルチコステロンによって先に作られちゃってると、抑制かかってCYP11B2は発現誘導されないってことか。
ちなみに、DOCやコルチコステロンを合成するCYP11B1(P450-11β)は、球状層だけでなく束状層や網状層の細胞も持っているとこちらの報告にあり、だからこそP450-17α欠損ではアルドステロンではなく、DOCやコルチコステロンによって低カリウム性高血圧になるんだな。球状層以外の細胞でもワサワサ作っちゃうんだから。
余談になるが、CYP11B2が次世代降圧薬のターゲットとして今年の日本高血圧学会で発表があったらしく、トピックとして面白かったんで載せておく。Medical Tribuneより(原著が見つからん)。
Cushing症候群では免疫グロブリンは低下するか?
まずは手持ちのyear note 2016 D-67を見てみると、Cushing症候群、つまり慢性的なグルココルチコイド過剰では、白血球上昇がみられ、その分画は好中球メインであって、リンパ球と好酸球は低下、とある。
免疫グロブリン(Ig)はB細胞が作るわけだから、リンパ球が低下すればB細胞も減って、作られるIgも低下するだろうことは想像に難くないのだけど、はっきりと述べている資料は少ない。
こんな時頼れるのはup to date。しかし大学からのアクセスじゃないと全文見られないのが痛いところ。一部だけ抜粋引用なら良いはず。
B cells and antibody production - Numbers of circulating B lymphocytes are reduced by glucocorticoid administration, but to a much lesser extent than those of T cells. Synthesis of antibodies by B cells remains essentially unchanged following short-term administration, but mild to modest decreases in serum immunoglobulin G (IgG) levels have been observed following short (eg. two to four week) courses of glucocorticoids. Low-dose glucocorticoid therapy appears to have little, if any effect on antigen-stimulated antibody production.
やはりグルココルチコイドはB細胞を抑制するらしい。でもT細胞よりマイルドなんですって。だから短期間のグルココルチコイド投与じゃIg産生に影響しないけど、数週間以上の長期投与になってくると血中IgG濃度が下がってくるとのこと。
If glucocorticoids are administered chronically over a period of years, there may be a decrease in total serum levels of IgG and immunoglobulin A (IgA), possibly as a consequence of inhibition of T cell help and/or increased catabolism of generated antibody.
さらに数年以上のグルココルチコイド投与となってくると、IgGだけじゃなくIgAまで低下とな。これにはT細胞減少の影響やら、Igの異化なんてのも関わってくる。
However, glucocorticoids may acutely promote B cell immunoglobulin secretion indirectly via inhibition in the function of CD8+ suppressor T cells. The effects of glucocorticoids on serum immunoglobulin levels may therefore be variable, depending upon the extent of steroid-induced antibody catabolism, the relative balance of T cell helper/suppressor functions, and/or concomitant immunosuppressive therapy.
ところがどっこいグルココルチコイドには、T細胞阻害によってむしろB細胞からIgの分泌を促進する作用なんてのもあるらしい。うーん、諸刃の剣グルココルチコイド。
In contrast, synthesis of immunoglobulin E (IgE) is often increased, which may be attributable to the enhancing effects of glucocorticoids on IL-4 induced B cell isotype switching to IgE.
さらにさらにIgEに関しては、IL-4でもってB細胞のクラススイッチを起こさせてIgE合成を増加させるときた。

とまあ、Igのクラスによってグルココルチコイドの作用は異なってくるようだけれども、血中Igの70-75%はIgGなので、慢性的にグルココルチコイドが過剰なCushing症候群では基本的にIg低下と考えて良いでしょう。
食塩感受性とは?
東大名誉教授の資料によると、
1)腎内レニン-アンジオテンシン系亢進が近位尿細管のAT1受容体刺激、
2)腎交感神経活性亢進が遠位尿細管のGR-WNK4-NCC系亢進、
3)Rac1-MR系異常活性化が集合管のENaC(上皮性Naチャネル)活性亢進
の三つの異なる機序によってNa再吸収亢進を生じ食塩感受性高血圧をきたす。

とある。
つまり同じだけの食塩摂取量だったとしても、遺伝的あるいは後天的な要因により上記のメカニズムが亢進している個体の場合、Naの再吸収が活発なために高血圧となる。これが食塩感受性高血圧なるものらしい。
うちの卒業試験では、「食塩感受性とは、Naを体外へ排出する際に血圧が大きく上昇する個体の性質である。」かどうかが問われていた。
確かにNaを体外に排出する際のメカニズムが再吸収亢進に傾いていることによって血圧が上昇するんだけども、この選択肢ちょっと言葉足らずじゃないですかね。
受傷後早期にハローベストを施行するか?
まずは雪山滑太さんの体験談をお読みくだされ。
決して典型的な頚椎損傷の現病歴ではないが、その治療経過や心理模様を詳細に物語っている。
雪山さんも装着されているハローベストとは、こういうものである。

雪山さんは、直達牽引を施行された後にハローベストへと移行しておられたが、初期治療でいきなりハローベストがあり得るかが疑問だった。
頚椎損傷についてこちらの資料には、
主損傷が骨組織か靭帯組織かによって、治療法は大きく左右されます。骨傷の中で、転位が残ってもほとんど障害のない損傷や、整復が比較的容易で骨癒合が良好な損傷(「楔状圧迫骨折」など)では、保存的治療が選択されます。整復が容易であっても骨癒合が起こりにくい損傷では、手術の適応となることが多くなります。
とあるが、
上位頸椎損傷においては、急性期において緊急手術を要することはまれ
らしく、
すべての頸椎損傷の治療は仰臥位での砂嚢固定で始まります。
とのこと。他の装具として、
簡易な頸椎カラー、フィラデル フィアカラー、オルトカラー、SOMI ブレースなどの固定力はいずれも大差はなく、主に前屈の制御目的で用いられます。さらに回旋力に対しても固定性の優れたものとしてハローベストがあります。
で、観血的治療を行うにしても、
主としてハローベストによる初期治療後の待機手術となります。
だそうなので、初期=受傷後早期のハローベスト施行はあると言って差し支えないでしょう。
ちなみに亀田メディカルセンターの資料によれば、
ハローベストによる外固定で骨癒合が得られる場合もあります
とする一方で、
早期の社会復帰を図るために後方固定術をお勧めしています。
とあり、雪山さんがあれからどうされてるか気になるところ。